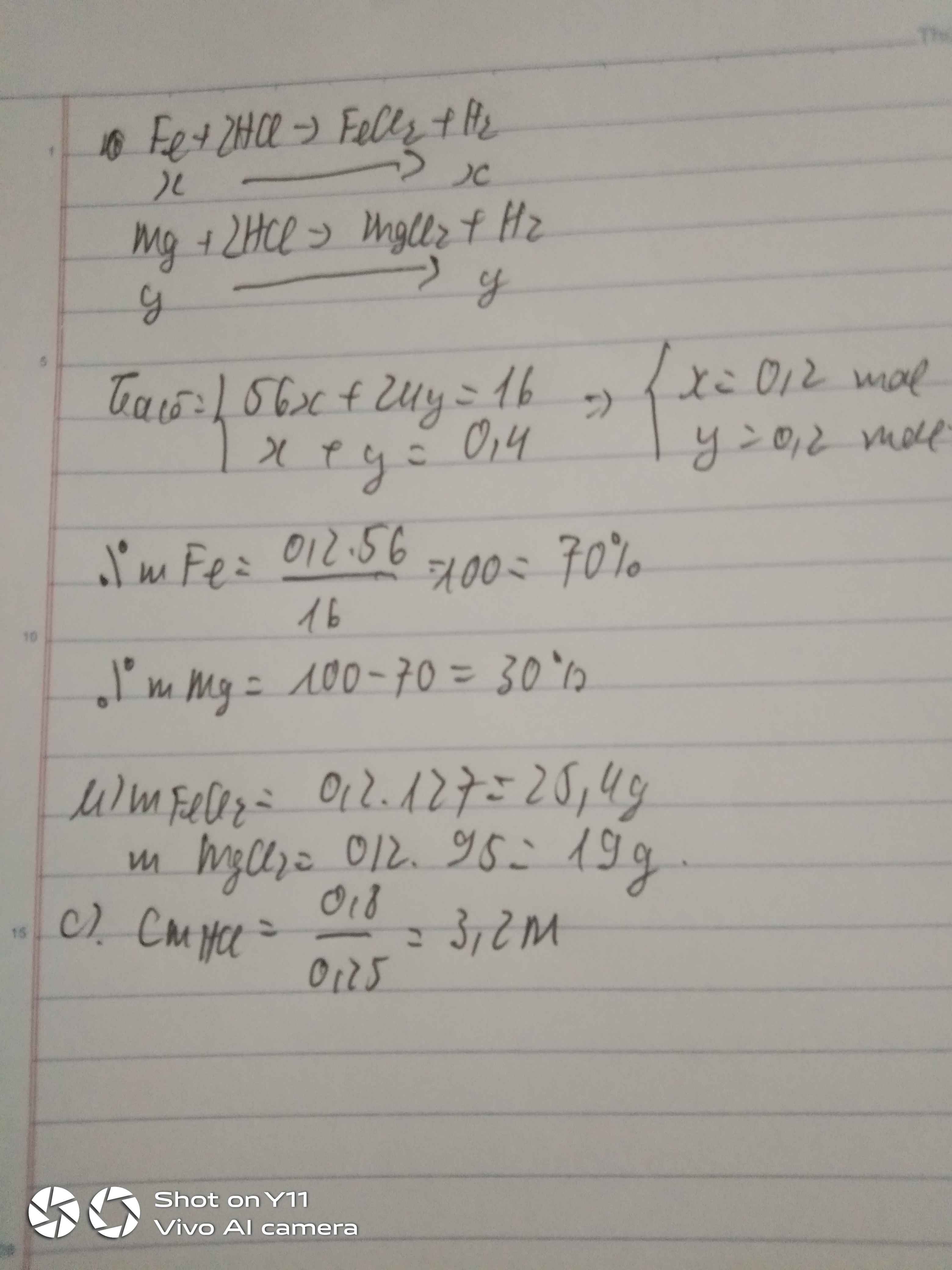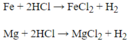Cho 16g hỗn hợp X gồm Fe và Mg tác dụng hoàn toàn với dung dịch HNSO , loãng thì thu được 8 , 96lit khí ở đktc
. a ) Tính khối lượng và thành phần % về khối lượng của Fe và Mg trong hỗn hợp đầu
. b ) Tính khối lượng dung dịch H2SO4 , 20 % đã phản ứng . c ) Cô cạn dung dịch sau phản ứng thu được m ( g ) muối khan . Tính giá trị của m ( g ) .